Oxakefemek és egyéb kefem vázanalógok
A kefalosporinok vázanalógjai esetén is hasonló volt a helyzet, mint a penicillineknél: már korán szintetizáltak különböző gyűrűanalógokat, azonban a szubsztitúciós viszonyok igen változatosak voltak, ezért igazából nem lehetett megítélni a biológiai hatásukat. A 70-es évek közepére több olyan származékot is szintetizáltak, amelyeknek minden szubsztituense "szabályos" volt, s csakhamar kiderült, hogy ezekkel érdemes tovább foglalkozni. Ebbe a munkába az összes jelentősebb cég beszállt, így a Merck, SmithKline, Bristol-Myers, stb. kutatói készítették el az első aktív származékokat: 1-oxacephalothin, 1-karbacephalothin, a 2-tia-, 2-oxa, 2-aza-származékokat. A triviális nomenklatura eléggé zavaros e származékok terén: például az izokefem, 1-detia-2-tiakefem és 2-tiakefem elnevezés mind ugyanazt a vegyületet jelöli, amikor a kénatom a kettes helyzetben van.
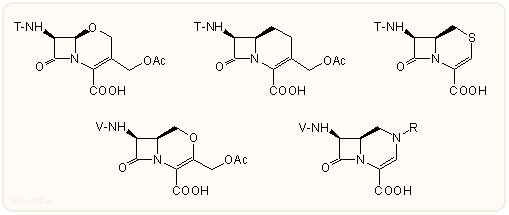
A különböző analógok összevetéséből kiderült, hogy a nitrogén származékok általában gyengébbek a megfelelő kefemnél, a karba-, 2-tia és 2-oxa-származékok hasonlóak a kefemhez, az 1-oxa-származékok is hasonlóak vagy jobbak. A továbbiakban nagy számú, nem racem származékot állítottak elő, főleg 1-oxa-kefemeket. Az 1-tia- és az analóg 1-oxa-származékok pontosabb összehasonlításából kiderült, hogy az S→O helyettesítés a Gram-pozitív hatást kissé, a Gram-negatív hatást jelentősen javítja, a különböző β-laktamáz enzimekkel szembeni stabilitást viszont csökkenti. In vivo a szérumkötődés csökken. Egyúttal megdőlt az a korábbi hit is, miszerint a kénatom elengedhetetlen feltétele a β-laktám antibiotikumok biológiai hatásának.
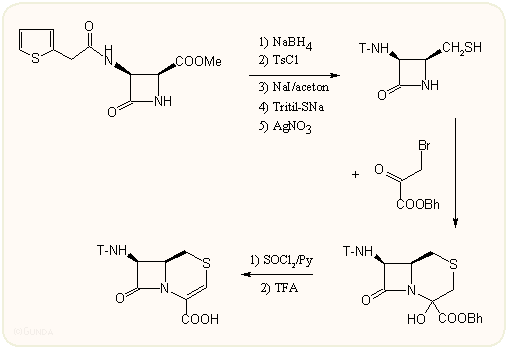
2-Tia-kefalosporinok (izokefemek)
A vegyületek előállítására jellegzetes példaként álljon itt a 2-tiaszármazék (izokefem) szintézise. A kiindulási azetidinon cikloaddícióval állítható elő azido-acetilkloridból és a megfelelő Schiff-bázisból. Redukció, majd többszörös nukleofil cserék után a kapott merkaptánt β-bróm-piroszőlősav benzhidrilészterrel reagáltatják (illetve egyéb halogeno-ketokarbonsavakkal, ha 3-szubsztituált végtermék a cél), majd eliminációval alakul ki a kivánt váz. Bár az izokefemek is hatékony molekulák, azonban annyival nem jobbak az eredeti vegyületeknél, hogy megérné a jóval bonyolultabb előállítás.
1-Oxa-kefalosporinok (oxakefemek)
Mint már fentebb említettük, a kén helyett oxigén atomot tartalmazó kefalosporinok igen jónak bizonyultak. A vizsgált származékok közül elsőnek az Eli Lilly vegyülete és moxalactam (Latamoxef) néven került humán alkalmazásra, ezt követte a japán Shionogi által előállított flomoxef. A moxalactamban minden jellegzetes elem benne van, ami egy jó Gram-negatív hatású vegyülethez kell: az S-tetrazol rész a jó farmakokinetikát, a 6α-metoxi csoport a β-laktamáz enzimmel szembeni ellenállást, a 6β-fenilmalonil oldallánc a Gram-negatív és Pseudomonas elleni hatást, a p-hidroxifenil csoport szintén a kedvező farmakokinetikát biztosítja. Antibakteriális hatásspektruma jelentősen szélesebb a régebbi kefalosporinoknál, hasonló cefotaximéhoz, így a harmadik generációs kefalosporinokhoz sorolható. A Gram-negatív patogén organizmusok elleni hatása hasonló az aminoglikozidokéhoz. Pseudomonas elleni hatása hasonló a tikarcillinéhez vagy karbenicillinéhez, valamivel elmarad a tobramicin és gentamicinétől. A moxalactam nemcsak ellenáll a különböző penicillináz és kefalosporináz enzimeknek, hanem azokat gátolja is. Különböző β-laktamáz enzimekkel szemben igen ellenálló, illetve gátolja azok hatását más, arra érzékeny vegyületeknél, így kombinációban szinergisztikus hatású.


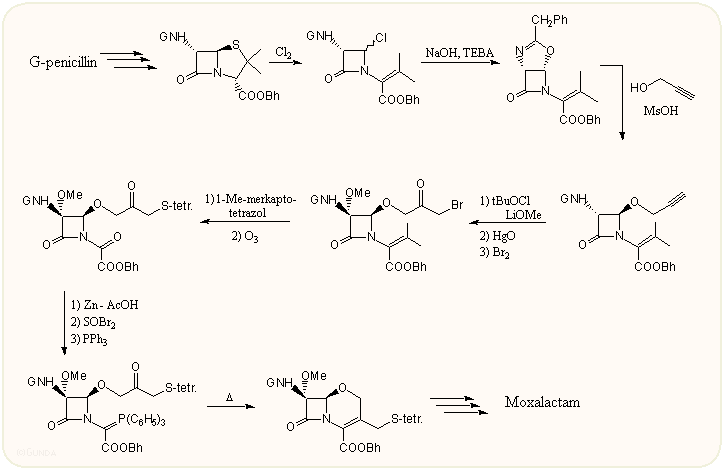
Az oxakefemek sikerét mutatja, hogy szintéziseikre sok nagy cég kidolgozta a módszerét, pl. csak a japán Shionogi cég oxakefem szintézisének kilenc változata ismert. A következő ábrán látható variáció epimerizált penicillinből indul ki, s a tiazolidin gyűrűt halogénezéssel nyitják, majd a más szintézisekben is alkalmazott oxazolin származékot alakítják ki, ebből pedig egy acetilén származékot. A 7α-metoxi csoport bevitele után többé-kevésbé szabványreakciókkal alakítják ki a Wittig reakciós gyűrűzáráshoz szükséges oldalláncokat, beleértve a majdani 3-as oldallánc ariltio szubsztituensét is. Végül a védőcsoportok eltávolításával és a 7β-oldallánc kialakításával megkapják a moxalactámot:
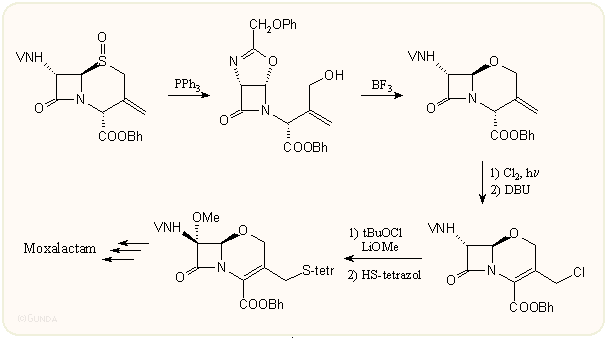
A talán legrövidebb és frappánsabb oxakefem szintézis az Eli Lilly kutatóihoz fűződik. A kiindulási 3-exometilén származék penicillin-szulfoxidokból könnyen nyerhető, s ebből trifenilfoszfinnal egy oxazolidin származék, majd újabb gyűrűzárással oxakefem kapható. Ez utóbbi átalakulás a 7-epi származékokra jellemző. Az amid csoport a C-7 atomon a metoxi csoport bevitelekor visszakerül a β helyzetbe:
2-Oxa-kefemek (izo-oxakefemek)
A 2-oxa-kefemek előállításának kulcslépése általában a következő, az O-mezil csoport nukleofil helyettesítésén alapuló reakció. E módszerrel a japán Otsuka cég munkatársai és taiwani kutatók készítettek több származékot, amelyek közül az alábbi OCP-9-176 azonos hatású, sőt valamivel szélesebb spektrumú, mint a cefmenoxim vagy cefuzonam. Nincs forgalomban.
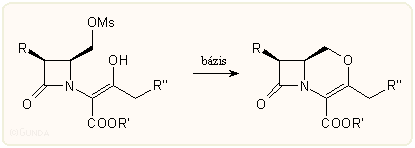
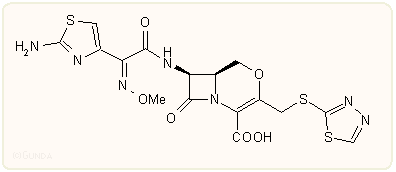
Karbakefemek
A kefalosporinok kénatomját szénnel helyettesítve a karbakefemekhez jutunk. Hatásuk az eddigi tapasztalat szerint hasonló a megfelelő kefalosporinéval, sőt egyes esetekben jobb is lehet. A 80-as évek legvégén hozta forgalomba az első ilyen anyagot az Eli Lilly, a loracarbacefet (Lorabid™), amely tulajdonképpen a cefachlor karba analógja. Az LY 206763 viszont nem jutott túl a kísérleti fázison.

A szintézisükre több változatot is kidolgoztak. Az első példában a kiindulási vegyületet a megfelelő Schiff-bázisból királis Staudinger reakcióval állítják elő. Az 1-es és 4-es helyzetben megfelelő észtereket kialakítva a gyűrűzárást Dieckmann kondenzációval hajtják végre. A keletkezett 3-keto-kefam gyakorlatilag teljesen enol formátumú és könnyen a 3-klór származékká alakítható, majd szokásos védőcsoport cserékkel a kívánt végtermékké alakítható.
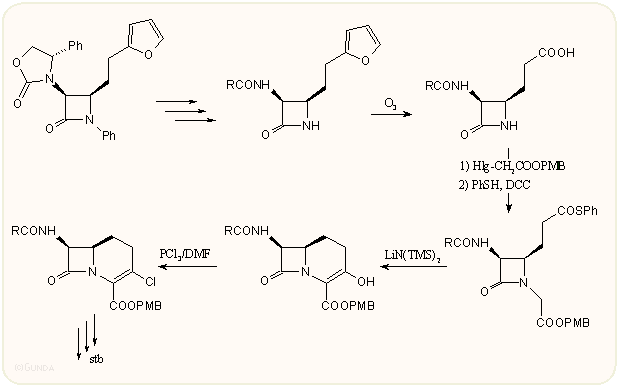
Végezetül egy új, a Horner-Wadsworth-Emmond metodológiát követő gyűrűzárást mutatunk be. A kiindulási hidroxi-dipeptidet Mitsunobu reakcióval zárják β-laktám származékká, majd több oxidációs lépésben alakítják ki a következő gyűrűzáráshoz a 4-oldalláncot. A karbakefem gyűrűt végül NaH-del ciklizálják:
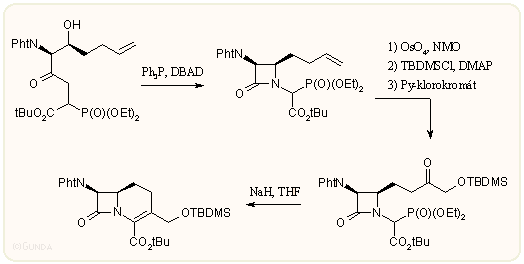
Az előzőekben ismertetett szintézisek variálásával az évek folyamán sok változatos szerkezetű hét vagy magasabb gyűrűtagszámú analógot is szintetizáltak, egy vagy több heteroatommal. Ezek azonban legfeljebb gyenge antibakteriális hatást mutattak, mégha az oldalláncaik azonosak is voltak a jó hatású kefemekéivel. Az alábbi ábrán láthatunk néhányat mutatóban:
